
��Ŀ�� ��Դ�� �}�ͣ�����}
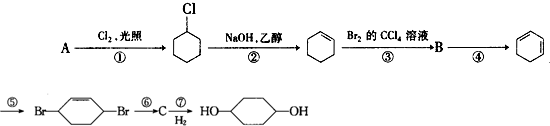

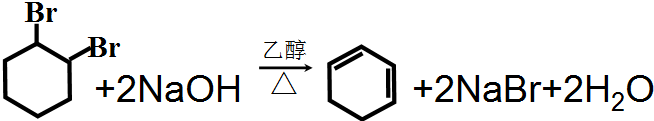 �������Ļ��W����ʽ��
�������Ļ��W����ʽ��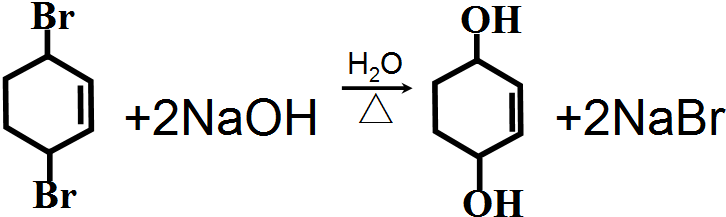 ��
���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ���������ԭ�ӵ�늺ɔ�(sh��)����λ��(sh��)����6 | |
| B�� | ԓ����������ƽ�������νY(ji��)��(g��u) | |
| C�� | Cl-��NH3���Ӿ����c��λ | |
| D�� | Cl-�]�й���ӣ�NH3�й���� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | SO3�cHCHO | B�� | BF3�cNH3 | C�� | BeCl2�cSCl2 | D�� | H2O�cSO2 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| ���w | NaCl | MgO | AlBr3 | SiCl4 | ���r������R |
| ���c���棩 | 801 | 2852 | 97.5 | -70 | 1723 |
| ���c���棩 | 1413 | 3600 | 263.3 | 57 | 2230 |
| A�� | SiCl4�Ƿ��Ӿ��w | B�� | MgO��NaCl�ľ����ܴ� | ||
| C�� | R��ԭ�Ӿ��w | D�� | AlBr3���x�Ӿ��w |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
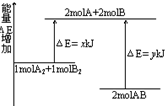
| A�� | ԓ���������ᷴ�� | |
| B�� | ����2molAB��Ҫ���՟���y-x kJ | |
| C�� | ����1molA-A�I��1molB-B�I�ɷų�xkJ���� | |
| D�� | ����2molA-B�I��Ҫ����ykJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ȼ�ϵ�ȼ���������Ƿşᷴ�� | |
| B�� | һ������ȼ����ȫȼ���ų��ğ����Ȳ���ȫȼ���ų��ğ����� | |
| C�� | �ӟ����ܰl(f��)���Ļ��W���������ᷴ�� | |
| D�� | �şᷴ�����淴��һ�������ᷴ�� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
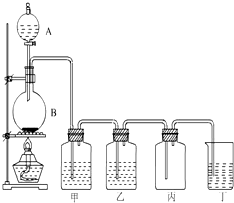 ��D�錍�����ȡ�Ț���b�ÈD��Ո����(j��)ԓ�D�ش����І��}��
��D�錍�����ȡ�Ț���b�ÈD��Ո����(j��)ԓ�D�ش����І��}���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| ���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� | �� |
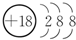 ��
���鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
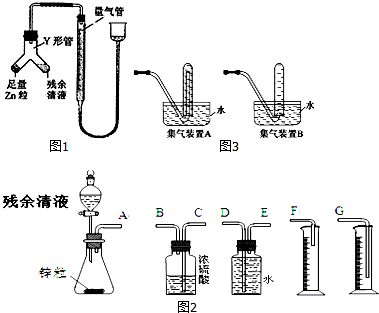
�鿴�𰸺ͽ���>>
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com