
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | �����������w����ĠI�B(y��ng)�� | |
| B�� | ��������C��H��O���NԪ�ؽM�� | |
| C�� | �����������w��(n��i)��ֱ���M(j��n)����ꐴ��x | |
| D�� | ÿ�������DZ������ų�������ֵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | Na | B�� | Mg | C�� | Cl | D�� | Ne |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ��λ�r(sh��)�g��(n��i)����n molO2��ͬ�r(sh��)����2n mol NO2 | |
| B�� | ��λ�r(sh��)�g��(n��i)����n molO2��ͬ�r(sh��)����2n mol NO2 | |
| C�� | NO2�ķֽ����ʵ���O2���γ����� | |
| D�� | ����(y��ng)���������ĝ����� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | CaCl2 �� NaHS | B�� | Na2O ��Na2O2 | C�� | CO2 ��HCl | D�� | Na2O2 ��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | NO�cO2����(y��ng) | B�� | ��ӟ����A | C�� | ����⛼ӟ�ֽ� | D�� | �Ȼ��c����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}


�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
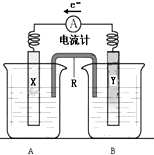 ��D���~�\ԭ늳��b�ã���늳صĿ�����(y��ng)�ǣ�
��D���~�\ԭ늳��b�ã���늳صĿ�����(y��ng)�ǣ��鿴�𰸺ͽ���>>
�ٶ����� - ����(x��)���б� - ԇ�}�б�
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��(b��o)ƽ�_ | �W(w��ng)���к���Ϣ�e��(b��o)���^(q��) | ����p�_�e��(b��o)���^(q��) | ��vʷ̓�o���x�к���Ϣ�e��(b��o)���^(q��) | �����֙�(qu��n)�e��(b��o)���^(q��)
�`���Ͳ�����Ϣ�e��(b��o)�Ԓ��027-86699610 �e��(b��o)�]�䣺58377363@163.com