
科目: 來源: 題型:解答題
| 滴定次數(shù) 實驗數(shù)據(jù) | 1 | 2 | 3 | 4 |
| V(樣品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初讀數(shù)) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(終讀數(shù)) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
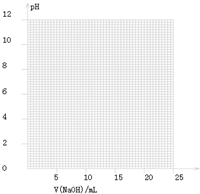
| 指示劑 | 變色的范圍(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
查看答案和解析>>
科目: 來源: 題型:單選題
查看答案和解析>>
科目: 來源: 題型:解答題
 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑ 2NaOH+Cl2↑+H2↑該反應中氧化劑是______,還原劑是______.
2NaOH+Cl2↑+H2↑該反應中氧化劑是______,還原劑是______.查看答案和解析>>
科目: 來源: 題型:單選題
查看答案和解析>>
科目: 來源: 題型:解答題
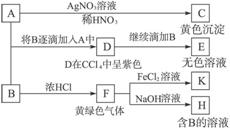
查看答案和解析>>
科目: 來源: 題型:解答題
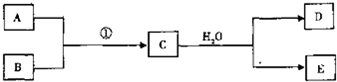
查看答案和解析>>
科目: 來源: 題型:解答題
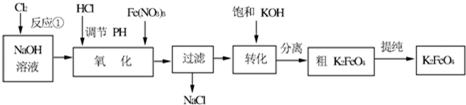
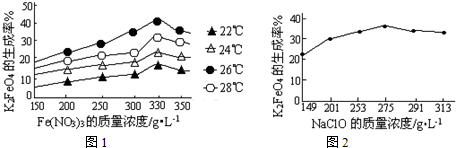
查看答案和解析>>
科目: 來源: 題型:單選題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com