
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
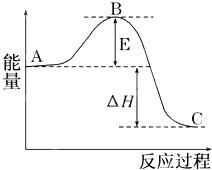 2SO2(g)+O2(g)?2SO3(g)反應(yīng)過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反應(yīng)過程的能量變化如圖所示.已知1mol SO2(g)氧化為1mol SO3(g)的△H=-99kJ/mol.查看答案和解析>>
科目: 來源: 題型:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
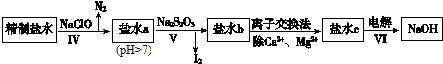
查看答案和解析>>
科目: 來源: 題型:
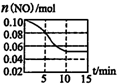 汽車尾氣中含有NO和CO等有害氣體.選擇適當(dāng)?shù)拇呋瘎┛蓪O、NO轉(zhuǎn)化為無毒氣體.
汽車尾氣中含有NO和CO等有害氣體.選擇適當(dāng)?shù)拇呋瘎┛蓪O、NO轉(zhuǎn)化為無毒氣體.查看答案和解析>>
科目: 來源: 題型:
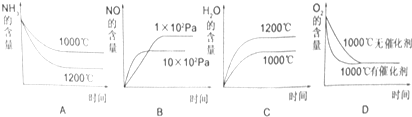
| 時間/濃度(mol/L) | C(NH3) | C(O2) | C(NO) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
查看答案和解析>>
科目: 來源: 題型:
| 3 |
| 2 |
| 1 |
| 2 |
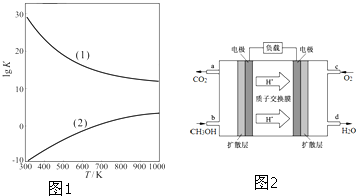
查看答案和解析>>
科目: 來源: 題型:
 天然氣的主要成分甲烷燃燒生成二氧化碳和液態(tài)水的熱化學(xué)方程式是:
天然氣的主要成分甲烷燃燒生成二氧化碳和液態(tài)水的熱化學(xué)方程式是:查看答案和解析>>
科目: 來源: 題型:
| 9a+b |
| 3 |
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com