
��Ŀ�� ��Դ�� �}�ͣ�����}
 �c����NaOH��Һ�����Ļ��W����ʽ______
�c����NaOH��Һ�����Ļ��W����ʽ______�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
 Na2CO3+CO2��+H2O
Na2CO3+CO2��+H2O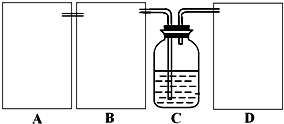

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ����x�}
 2K2MnO4+2H2O���ڶ�����늽��i�����Һ��2K2MnO4+H2O
2K2MnO4+2H2O���ڶ�����늽��i�����Һ��2K2MnO4+H2O  2KMnO4+H2��+2KOH�����f���������_����
2KMnO4+H2��+2KOH�����f���������_�����鿴�𰸺ͽ���>>
����ʡ���W�`���Ͳ�����Ϣ�e��ƽ�_ | �W���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙��e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com