
��Ŀ�� ��Դ�� �}�ͣ�����}

�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
| �M �� | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| �|���֔� | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
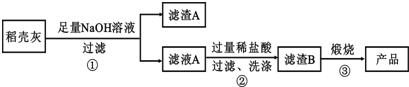
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | 0.1mol/LNa2SҺ�У�c��OH-��-c��HS-��-c��H+��=2c��H2S�� | |
| B�� | 0.2mol/L��NH3•H2O��Һ��0.1mol/LHCl��Һ���w�e��ϣ�pH��7����c��NH4+��+c��H+����c��NH3•H2O��+c��OH-�� | |
| C�� | 0.1mol/L pH=7.8��NH4HCO3��Һ�У�c��HCO3-����c��NH4+����c��OH-����c��H+�� | |
| D�� | 0.1mol/L Na2SO3��Һ�c0.1mol/L NaHSO3��Һ���w�e��ϣ�2c��Na+��-3c��SO32-��=3c��HSO3-��+3c��H2SO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | vA=0.15mol•L-1•min-1 | B�� | vB=0.6mol•L-1•min-1 | ||
| C�� | vC=0.35mol•L-1•min-1 | D�� | vD=0.02mol•L-1•s-1 |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | ��} | B�� | �c�} | C�� | �}�} | D�� | �~�} |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ��x���}
| A�� | �٢ڢۢ� | B�� | �٢ڢ� | C�� | �ڢݢ� | D�� | �٢ܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
��Ŀ�� ��Դ�� �}�ͣ�����}
�鿴�𰸺ͽ���>>
����ʡ���W�`���Ͳ�����Ϣ�e��ƽ�_ | �W���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙��e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com