
科目: 來源: 題型:
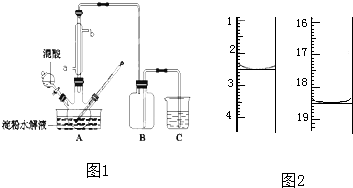
 利用如圖裝置收集以下幾種氣體(如圖中燒瓶位置不得移動)
利用如圖裝置收集以下幾種氣體(如圖中燒瓶位置不得移動)查看答案和解析>>
科目: 來源: 題型:
| 面粉酸度 | <2° | 2°-4.5° | >4.5° |
| 面粉品質(zhì) | 新鮮面粉 | 陳年面粉 | 霉變面粉 |
查看答案和解析>>
科目: 來源: 題型:
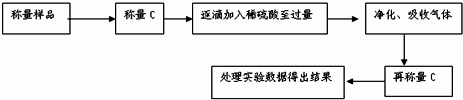
查看答案和解析>>
科目: 來源: 題型:


查看答案和解析>>
科目: 來源: 題型:
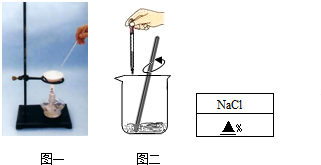
| 蒸發(fā)皿的質(zhì)量 | 蒸發(fā)皿的質(zhì)量+食鹽溶液的質(zhì)量 | 蒸發(fā)皿的質(zhì)量+食鹽晶體的質(zhì)量 |
| 28.8克 | 48.8克 | 30.7克 |
查看答案和解析>>
科目: 來源: 題型:
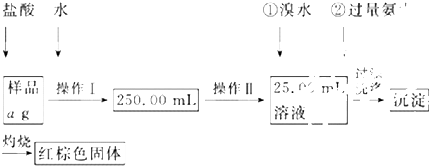
查看答案和解析>>
科目: 來源: 題型:
查看答案和解析>>
科目: 來源: 題型:
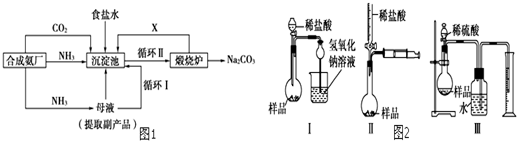
查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
科目: 來源: 題型:

查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com