【題目】Ⅰ.由三種元素組成的化合物A���,按如下流程進(jìn)行實(shí)驗(yàn)���。
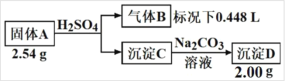
氣體B為黃綠色氣體單質(zhì)�, 沉淀C和D焰色反應(yīng)為均為磚紅色。
(1)組成A的三種元素是______���,A的化學(xué)式是______
(2)固體A與足量稀硫酸反應(yīng)的化學(xué)方程式是______����。
(3)請從化學(xué)反應(yīng)原理的角度解釋(結(jié)合化學(xué)方程式)為什么沉淀C能轉(zhuǎn)化成 D______����。
Ⅱ.常用的補(bǔ)鐵劑有硫酸亞鐵等,而乳酸亞鐵被人體吸收的效果比無機(jī)鐵好�,它溶于水形成淡綠色的透明溶液,幾乎不溶于乙醇�。它的制備方法有兩種:一是在FeCO3中加入乳酸;二是利用廢鐵屑制取純凈的三水合乳酸亞鐵晶體�,其實(shí)驗(yàn)流程如下圖所示:
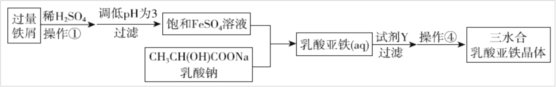
(1)寫出制備方法一的離子反應(yīng)方程式_______;
(2)操作①中不需要用到的儀器為________;
A.玻璃棒 B.坩堝 C.坩堝鉗 D.蒸發(fā)皿
(3)加入過量的試劑Y為_______���。