
ҝЖДҝЈә ҒнФҙЈә о}РНЈәйҶЧxАнҪв
| ||
| ||
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈә ҒнФҙЈә о}РНЈә
| ||
| ||
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈә ҒнФҙЈә о}РНЈә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈә ҒнФҙЈә о}РНЈә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈә ҒнФҙЈә о}РНЈә
| ҢҚтһҙО”ө(shЁҙ) | өЪ1ҙО | өЪ2ҙО | өЪ3ҙО | өЪ4ҙО |
| јУИлөДПЎБтЛбөДЩ|Бҝ/g | 5 | 5 | 5 | 5 |
| ҹэұӯЦРКЈУа№МуwөДЩ|Бҝ/g | 4.2 | 3.4 | 3.0 | 3.0 |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈә ҒнФҙЈә о}РНЈә
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈә ҒнФҙЈә о}РНЈә
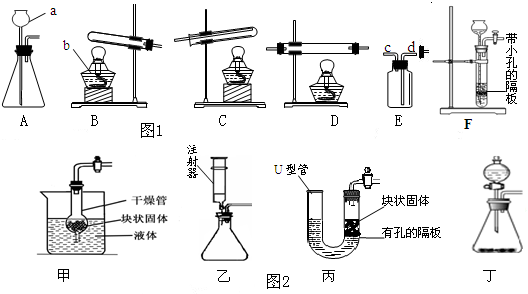
| ||
| ||
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - ҫҡБ•ғФБРұн - ФҮо}БРұн
әюұұКЎ»ҘВ“(liЁўn)ҫWЯ`·ЁәНІ»БјРЕПўЕeҲуЖҪЕ_ | ҫWЙПУРәҰРЕПўЕeҲуҢЈ…^(qЁұ) | лҠРЕФpт_ЕeҲуҢЈ…^(qЁұ) | ЙжҡvК·М“ҹoЦчБxУРәҰРЕПўЕeҲуҢЈ…^(qЁұ) | ЙжЖуЗЦҷаЕeҲуҢЈ…^(qЁұ)
Я`·ЁәНІ»БјРЕПўЕeҲулҠФ’Јә027-86699610 ЕeҲуа]ПдЈә58377363@163.com